立项须知
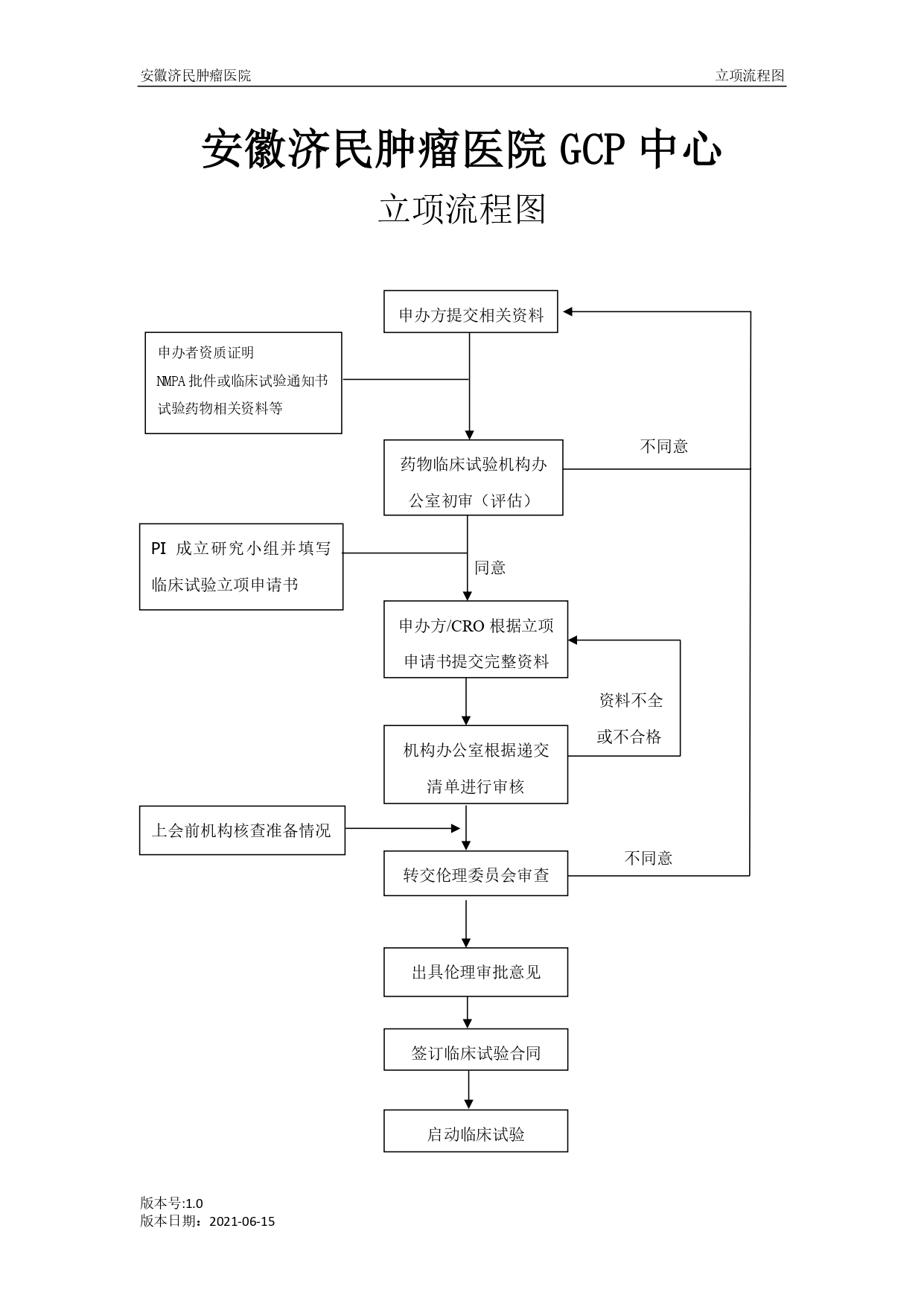
一、线上申请流程:
将线下申请所需要的文件发送至机构邮箱:ahjmgcp@163.com进行初步审核,审核同时需同步进行纸质版资料的准备和递交(三个工作日内完成)。
二、线下申请流程:
1. 联系人:机构秘书:路明/刘思雨;联系电话:17710827900;邮箱:ahjmgcp@163.com
2. 新药临床试验的申请人在获得国家药品监督管理局的批文后(或通知书、备案信),将批复复印件和与新药有关的资料提交给机构管理办公室,由机构执行主任决定是否承接该项研究。
3. 机构执行主任审阅资料后,根据该药的特点、临床研究难度和我中心的承担能力决定是否承接该项目。
4. 如果决定承担该项研究后,由机构执行主任结合申办方意向确认主要研究者(PI)。
5. 如果新药申办者直接与我院研究者联系,研究者应当向机构执行主任提出申请,批准之后才可正式接受该项临床试验。
6. 申办者应当按照我院GCP中心的《安徽济民肿瘤医院药物临床试验立项申请书》(附件一)要求,提交纸质版资料1套(蓝色快劳夹装订,文件需打孔,盖章,长篇幅文件需加盖骑缝章),电子版资料1套,机构办公室在3个工作日内对提交完整的文件进行初审,初审通过后将立项申请表交机构办公室主任签字立项。
7. 立项通过后提交伦理委员审查,伦理审查材料内容详见《药物临床试验伦理审查申请表》(附件二)。伦理委员会秘书负责对提交的材料数量格式进行审核。伦理委员会电话0551-64859746,联系人:于知恩(伦理秘书),邮箱:872933844@qq.com
8. 伦理秘书审核文件后,根据伦理委员会会议安排,通知机构办公室项目管理员、申办方/CRO上会的计划时间。
9. 申办方/CRO接到伦理会的通知以后,对伦理汇报人员(一般为PI)进行培训,培训及其他准备完成后,通知机构办公室,进行上会前核查,主要核对以下内容:
10. 伦理初审的材料版本号及日期;
11. 递交回执是否无误;
12. 电子资料的版本内容是否一致;
13. 申办方/CRO、研究者等是否已明确上会时间并做好准备。
14. 伦理委员会对提交的项目进行审批,通过之后出具临床试验批件。
15. 伦理审查的同时可以进行合同的商讨、起草工作。
16. 申办方/CRO取得批件以后,方可开展项目。如果伦理委员会审批之后提出修改意见,则应当进行修改,然后将修改后的文件提交伦理委员会复审,通过之后才可以开展项目。
17. 项目启动会需在主合同签署之后。
18. 生物等效性实验的审批等流程由Ⅰ期及BE研究室单独负责。
![]() 附件二:AF010-3-2.1药物临床试验伦理审查申请表.doc
附件二:AF010-3-2.1药物临床试验伦理审查申请表.doc