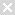机构内部质控流程
一、质控人员:
程刚;刘瑞波;路明;刘宇飞
二、时间节点:
对于在我院肿瘤专业进行的所有新药临床试验,质控工作的开展原则上设立三个节点,分别是:
首例质控:入组达到1例,且CRA已完成该1例病例的全部核查,机构进行首例质控。
安全性质控:发生SAE/SUSAR:针对SAE/SUSAR发生的病例进行关注,必要时进行安全性质控。
中期质控:根据项目具体进展情况进行质控,项目入组>3例时,抽查总入组数30%的病例文件。
关中心质控:入组结束时或全部病例出组后对30%病例进行抽查。
在整个项目实施期间,机构至少进行两次质控。
三、质控流程:
机构办公室设立项目质控小组,在每次质控前,按照计划的时间,质控人员应提前15个自然日对质控项目的申办方、研究者发出书面通知,沟通确定质控时间、地点、内容,并告知专业科室、GCP药房、检验科等辅助科室协助进行质控。质控完成后,质控组长应在10个工作日内完成《项目质控报告》(详见附件一),并通知各方召开质控总结会议,会议中应对核查情况进行确认,对于发生的质控问题要落实到人,对有重大违规现象的研究者及时终止其研究资格,并组织人员进行二次核查。质控总结会后申办方及研究者应在20个工作日内完成整改,以及CAPA报告(详见附件二)并提交机构质控员人员进行全面复查,并在《项目质控报告》签字后,交给机构办公室主任和负责质控的机构副主任确认,保存于机构质控文件夹中。
四、质控内容:
质控的内容应包含试验文件、试验程序、知情同意书签署情况、原始文件与CRF、协议遵守情况、GCP执行情况、伦理审批情况等,必要时与研究者、CRC/CRA共同讨论发现的问题。
五、质控对象:
肿瘤专业针对注册类、有入组的项目,每个项目至少有2次质控。
BE专业采取抽查的形式,BE项目质控员根据项目的入组、AE等情况制定质控计划,关中心前通知机构质控员进行内部质控。

![]() 附件二:AHJM_GCP_11(GCP质控整改回复报告模板).docx
附件二:AHJM_GCP_11(GCP质控整改回复报告模板).docx