临床试验关中心的操作流程
一、联系人及联系方式:
机构秘书:路明/刘思雨 联系电话:17710827900
二、关闭中心的时间点:
1、当临床研究全部结束时,包括用药、随访结束、全组总结报告递交;
2、当全组研究未结束,我院临床研究结束时(完成全部随访,数据收集结束,或完成小结报告)。
3、当全组及我院研究结束(完成全部随访),但全组统计报告尚未总结和递交。
4、其他特殊原因结束临床试验。
三、临床试验关闭中心内容
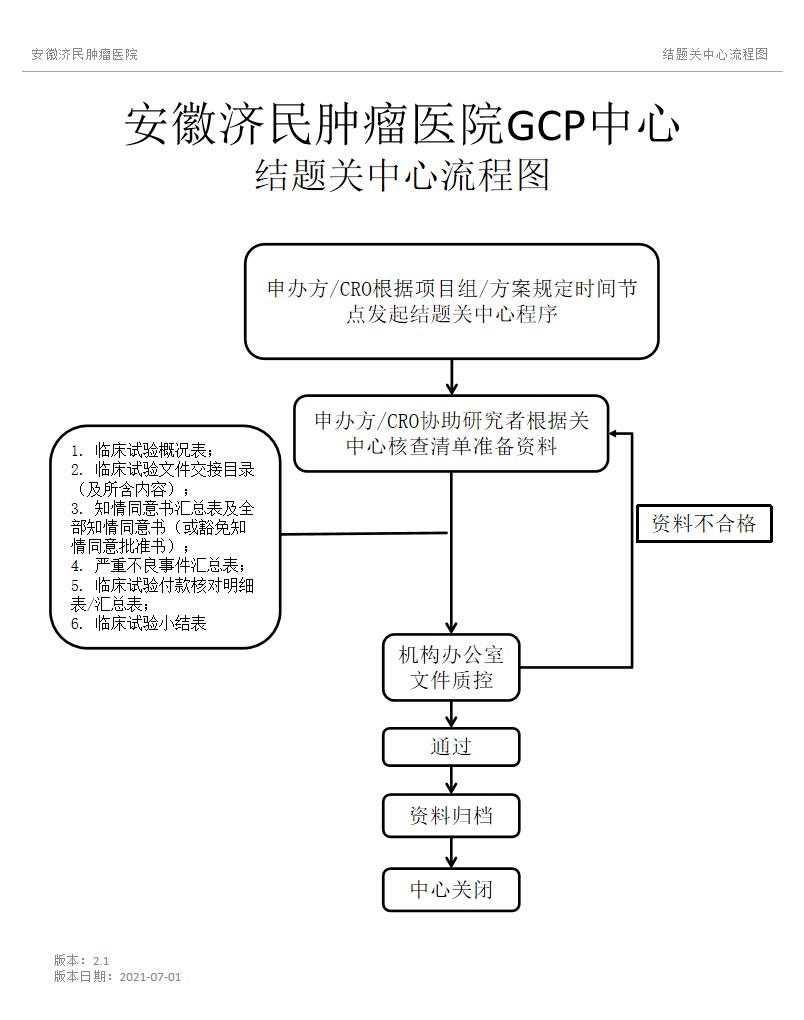
在关闭中心过程中,我院要求提交以下6个表格中所含内容(详见附件内容):
1、临床试验概况表;
2、临床试验文件交接目录(及所含内容);
3、知情同意书汇总表及全部知情同意书(或豁免知情同意批准书);
4、严重不良事件汇总表;
5、临床试验付款核对明细表/汇总表;
6、临床试验小结表
7、其他:视项目情况决定。
四、关闭中心的方法
1、临床研究申办方在准备关中心时,可在我院药物临床研究机构网站中(http://www.ah-zl.com/list-36.html)找到关中心文件保存要求的文件(即关中心内容所述的六项表格),请按照表格内容填写完整;
2、关闭中心时申办方需要将研究者文件夹、CRF表及上述六项表格(表格一式两份)中相关内容,到GCP中心档案室办理相关手续;
3、由于我院中心档案室空间有限,可能会根据项目情况要求把部分纸质内容(如IB等)转化为电子版存放;
4、有些项目的档案可能会易地保存,如第三方库房;
5、如需特别保存到第三方,请递交易地保存委托书。